
فسفر یک عنصر شیمیایی جدول تناوبی است که نماد آن P و عدد اتمی آن 15 میباشد. فسفر یکی از نافلزات چند ظرفیتی گروه نیتروژن بوده و معمولا در سخره ها و کانی های فسفاتی و همچنین در تمام سلولهای زنده یافت میشود ولی هیچگاه به صورت طبیعی تنها و بدون ترکیب با عناصر دیگر وجود ندارد. فسفر بسیار واکنش پذیر بوده و هنگام ترکیب با اکسیژن نور کمی از خود ساتع میکند. از عناصر لازم و حیاتی ارگان های زنده بوده و نامش به شکلهای گوناگون ذکر میشود. مهمترین استفاده فسفر در تولید کود میباشد. همچنین در تولید مواد منفجرهکبریتآتش بازی مواد حشره کش خمیر دندان و مواد شوینده و همچنین مانیتورهای کامپیوتر نیز کاربرد دارد.
فسفر معمولا به شکل یک ماده جامد و موم مانند سفید رنگ است که بوی نامطبوعی دارد. فسفر خالص بی رنگ و شفاف است. اگرچه این نافلز در آب قابل حل نیست ولی در دی سولفید کربن حل میشود. فسفر خالص به سرعت در هوا میسوزد و تبدیل به پنتا اکسید فسفر میشود.
فسفر به چهار پنج شکل مختلف وجود دارد . سفید (یا زرد) قرمز سیاه (یا بنفش). که متداول ترین آنها فسفر قرمز و سفید میباشند که که هر دوی آنان از گروه چهار اتمی های چهار وجهی میباشند. فسفر سفید در تماس با هوا میسوزد و در مجاورت با گرما یا نور به فسفر قرمز تبدیل میشود که دو حالت آفا و بتا دارد که با انتقال دمای -3.8 درجه سانتیگراد از هم تفکیک میشوند. در عوض فسفر قرمز پایدار تر بوده و در فشار بخار 1 اتمسفر در 17 درجه سانتیگراد تصعید می شود و از تماس و یا گرمای مالشی میسوزد. فسفر سیاه چندشکلی Allotrope هم در ساختاری مشابه گرافیت که در آن اتمها در یک صفحه شش وجهی چیده شده و هادی جریان الکتریسیته هستند وجود دارد.
اسید فسفریک غلیظ شده که 70% تا 75% P2O))5دارد. در(( کشاورزی و تولید کود بسیار مهم میباشد. در نیمه دوم قرن بیستم نیاز بیشتر به کودها تولیدات فسفری را به مقدار قابل توجهی افزایش داد.
دیگر کاربردهای فسفر عبارتند از:
- فسفر برای تولید شیشه مخصوص برای لامپهای سودیومی استفاده میشود.
- فسفات کلسیم یا Bone-Ash برای تولید ظروف چینی مرغوب و Mono_calcium Phosphate که در بکینگ پودر مصرف دارد استفاده میشود.
- همچنیند این عنصر در تولید فلزات برنز فسفات و دیگر فلزات استیل کاربرد دارد.
- تری سدیوم فسفات در ماده های تصفیه کننده برای شیرین کردن آب و همچنین جلوگیری از فرسایش لوله ها کاربرد دارد.
- از فسفر سفید در ساخت بمبهای آتش زا و دود زا و گلوله های رسام استفاده میشود.
- فسفر کاربردهای گوناگون دیگری در ساخت کبریتهای بی خطر مواد آتش زاحشره کش ها خمیردندان ها و مواد پاک کننده دارد.
ترکیبات فسفری نقش حیاتی در تمام گونه های حیات شناخته شده در زمین دارد. فسفرهای معدنی نقش کلیدی در ملوکولهای بیولوژیکی مانند DNAو RNA که قسمتی از استقامتهای ملوکولی را شکل میدهند بازی میکنند. همچنین سلولهای زنده از فسفرهای معدنی برای ذکیره و انتقال انرژی سلولی از طریق تری فسفات آدنوزین ATP استفاده میکنند. نمکهای فسفات کلیسیوم هم توسط حیوانات برای سفت شدن استخوان استفاده میشود. ضمناً فسفر یک عضو حیاتی برای پروتوپلاسمهای سلولی و بافتهای عصبی میباشد.
فسفر (که یونانی آن فسفروس به معنای"حامل روشنایی" و از نامهای باستانی سیاره زهره میباشد ) در سال 1669توسط شیمیدان آلمانی Henning Brand در حین تولید یک دارو از ادرار کشف شد. براند با تبخیر ادرار سعی در تقطیر نمک داشت که در این فرایند ماده سفید رنگی تولید شد که در تاریکی میدرخشید و با نور زیادی میسوخت. از آن روز تابندگی فسفری برای شرح اشیاءی که در شب بدون سوختن میدرخشند بکار برده شد.
کبریتهای اولیه که از فسفر سفید در ترکیباتشان اسفاده میشد به دلیل سمی بودن خطرناک بودند و استفاده از آنها موجبات قتل و خودکشی و .... را فراهم میکرد. (یک داستان نا معلوم حکایت از این دارد که زنی با اضافه کردن فسفر سفید به غذای شوهرش قصد کشتن وی را داشت که هنگام جوشانیدن غذا به دلیل به وجود آمد بخار نورانی لو رفت.)
همچنین کارگران کبریت ساز به دلیل مجاورت با بخار آن دچار مردگی استخوانهای فک میشدند. زمانی که فسفر قرمز که خاصیت آتش زایی و سمی به مراتب کمتری را دارد کشف شد جایگزین فسفر سفید در صنعت کبریت سازی گردید.
فسفر به دلیل واکنش پذیری در هوا و دیگر مواد حاوی اکسیژن به تنهایی در طبیعت یافت نمیشود ولی به صورت ترکیبی به مقدار زیادی در معادن گوناگون پخش شده اند. که بزرگترین این معادن در روسیه مراکش فلوریدا Idaho, Tennesseو Utah قرار دارد.
فسفرهای چندشکلی سفید میتوانند به شیوه های گوناگونی تهیه شوند. در یک فرایند تری کلسیم فسفات که از سخره های فسفاتی گرفته شده در مجاورت کربن و سیلیکا در کوره های سوختی یا برقی حرارت داده میشود. در این فرایند عناصر فسفری به صورت بخار آزاد شده و به صورت اسید فسفریک جمع آوری میشوند.
فسفر یک ماده بسیار سمی میباشد و حتی مقدار 50 mg آن کشنده و مرگ آور است.
فسفر سفید باید همیشه در زیر آب نگهداری شود چرا که در مجاورت هوا بسیار واکنش پذیر میباشد. هنگام کار با آن حتما باید از انبر استفاده شود چرا که تماس آن با پوست میتواند باعث سوختگی های مزمن شود. خاصیت سمی و مزمن فسفر سفید باعث میشود که کارگرانی که باید با آن کنند دچار بیماری Necrosis of the Jaw مردگی فک که اصطلاحا PhossyJaw نامیده میشود گرفتار آیند. استرهای فسفاتی برای سیستم عصبی سمی هستند اما فسفاتهای معدنی و کانی معمولا غیر سمی میباشند.
آلودگی فسفاتی نیز زمانی رخ میدهد که کودها و مواد پاک کننده در خاک ها باقی بمانند.
هنگامی که گونه سفید آن در مجاورت نور خورشید قرار بگیرد و یا در بخار خود تا دمای 250 درجه سانتیگراد حرارت داده شود به گونه قرمز که در هوا ترکیب نمیشود تبدیل میشود. فسفر قرمز فورا در هوا آتش نمیگیرد و به خطرناکی فسفر سفید نیست. با این حال باید با فسفر قرمز نیز با احتیاط کار شود چرا که در شرایطی و در تحت دماهای خاص ممکن است به فسفر سفید تبدیل شود . ضمنا در صورت گرما دیدن گازهای بسیار سمی که حاوی اکسیدهای فسفر هستند از خود ساتع میکند.
p32 ایزوتوپ رایج است که رادیو اکتیو نیز می باشد.
تنها املاء درست این عنصر Phosphorus میباشد که به شکل صفت برای ظرفیتهای کوچکتر آن استفاده میشود و درست همانند ترکبات گوگرد (sulfurour and sulfuric) میباشد و با کلمات Phosphorous و Phosphoric نامیده میشود.
فسفر از زمان های بسیار قدیم با اهمیت دانسته شده و مورد مصرف بوده است. در بیشتر اعمال فیزیولوژیکی گیاه ، فسفر اهمیت حیاتی دارد (از آن جمله : در تولید ATP و اسید نوکلئیک و آنزیم ها)، کمبود فسفر باعث توقف رشد گیاه شده و به علت انتقال فسفر از برگ های پیر به برگهای جوان، منجر به ریزش برگهای پیر میگردد. گهگاه، کمبود فسفر باعث تجمع مواد قندی در برگ و ساقه شده و در نتیجه تولید آنتوسیانین بالا رفته و برگها و ساقه ها به رنگ قرمز در می آیند.
در خاک، فسفر ممکن است به صورت معدنی و آلی یافت شود. واکنش (pH) خاک در قابل استفاده ساختن فسفر اهمیت زیادی دارد. فسفر در خاک های قلیایی، به املاح کلسیم، و در خاک های اسیدی با آهن و آلومینیم ترکیب شده غیر قابل استفاده میشود.
بنابراین مناسبترین واکنش برای قابل استفاده بودن فسفر واکنش های 6 تا 7 می باشد. فسفر به صورت های و یا جذب گیاه می شود.
از کودهای فسفره معمول که به مصرف میرسد می توان فسفات آمونیم، را نام برد.پودر استخوان گرچه دارای فسفر زیادی می باشد ولی فسفر آن زیاد قابل جذب نیست.
فسفر به چهار پنج شکل مختلف وجود دارد . سفید (یا زرد) قرمز سیاه (یا بنفش). که
متداول ترین آنها فسفر قرمز و سفید میباشند که که هر دوی آنان از گروه چهار اتمی
های چهار وجهی میباشند. فسفر سفید در تماس با هوا میسوزد و در مجاورت با گرما یا
نور به فسفر قرمز تبدیل میشود که دو حالت آفا و بتا دارد که با انتقال دمای -3.8
درجه سانتیگراد از هم تفکیک میشوند. در عوض فسفر قرمز پایدار تر بوده و در فشار
بخار 1 اتمسفر در 17 درجه سانتیگراد تصعید می شود و از تماس و یا گرمای مالشی
میسوزد. فسفر سیاه چندشکلی Allotrope هم در ساختاری مشابه گرافیت که در آن اتمها در
یک صفحه شش وجهی چیده شده و هادی جریان الکتریسیته هستند وجود دارد.
فسفر سفید به صورت مولکولهای مجزای چهار اتمی، چهار وجهی، بسیار فعال
(به علت وجود زاویه ی 60 درجه و فشاری که بر روی آن است) و زود گداز است.
فسفر
سفید دو حالت دارد آلفا و بتا.
فسفر سفید در زیر آب نگهداشته می شود باید آن را
با انبر جابجا کرد تماس آن با پوست دست باعث سوختگی شدید می شود.
شرایط حرارت
دادن فسفر مانند تحت فشار بودن یا نبودن منجر به تولید فرآورده های متفاوت می
شود.
وقتی فسفر سفید در معرض نور خورشید قرار بگیرد یا وقتی داغ شده باشد حرارت
آن به 250 درجه می رسد که می تواند در این حالت تبدیل به فسفر نوع قرمز شود. این
فرم از فسفر به راحتی و به خودی خود آتش نمی گیرد و به اندازه فسفر سفید خطرناک
نیست. در موقع کار با فسفر سفید باید بسیار دقت کرد چون هم بسیار سمی است و هم به
راحتی درجه حرارت آن بالا می رود و آتش می گیرد. فسفر قرمز نسبت به سفید دارای
پایداری بیشتری می باشد و برای ساخت کبریتهای بی خطر، مواد آتش بازی ، آفت کشها ،
آتش افروزها ، بمبهای دودزا و گلوله ها کاربرد دارد.
اما فسفر سفید در اثر
ترکیب با اکسیژن هوا در زمان سوختن تبدیل به پنتا اکسید فسفرمی شود . این اکسید،
شدیداً اسیدی بوده و در ترکیب با آب تولید فسفریک اسید می نماید:
P4 + 5O2
--- 2P2O5
P2O5 + 3H2O - 2H3PO4
درواقع P2O5 همان بخاراتی است که هنگام
سوختن فسفر سفید مشاهده می شود.
می دانید فسفر سفید به صورت P4 می باشد. حال
در فسفر قرمز یکی از پیوندهای بین 4 اتم فسفر در P4 شکسته می شود و با یک اتم فسفر
از یک P4 دیگر پیوند برقرار می کند درنتیجه فسفر قرمز به صورت P4n می باشد یعنی به
صورت 8 تایی، 12 تایی، 20 تایی و ... می تواند وجود داشته باشد
فسفر قرمز از
حرارت دادن فسفر سفید تا دمای 280 درجه سانتیگراد در ظرفهای سربسته (دور از هوا)
حاصل میشود. سمی و آتشگیر نیست و برخلاف فسفر سفید که جامد مولکولی است، فسفر قرمز
جزو جامدهای کووالانسی است و در دیسولفید کربن حل نمیشود.
در تهیه فسفز
قرمز از فسفر سفید واکنش خاصی اتفاق نمی افتد و تنها تغییر ساختار به وجود می
آید.
فسفر سیاه از تحت فشار قرار دادن فسفر سفید به دست می آید. هم چنین اگر
فسفر مایع در حضور جیوه به طور آهسته متبلور شود فسفر سیاه ایجاد می گردد. اتمها در
فسفر سیاه در قالب لایه های موجدار و متوازی و مطبق به یکدیگر متصل شده اند. در یک
لایه اتمها با نیروهای کووالانسی به هم متصل هستند در حالیکه در بین لایه ها فقط
نیروهای ضعیف لاندن وجو دارد. فسفر سیاه انحلال ناپذیر بوده و نسبت به سایر آلوتروپ
های فسفر از کمترین مقدار واکنش پذیری برخوردار است.
فسفر سفید یا فسفر زرد یا به بیان ساده تر تترافسفر (P۴) به صورت مولکولی یافت میشوند. این مولکولها از چهار اتم ساخته شدهاند. آرایش چهاروجهی دچار کشش حلقه و درنتیجه ناپایداری میشود.
فسفر سفید جامد شفاف و مومی شکل است و اگر در برابر نور قرار گیرد خیلی زود زرد میشود به همین دلیل است که به آن فسفر زرد نیز میگویند. در تاریکی درخشش سبز دارد (اگر در برابر اکسیژن قرار گیرد). به شدت آتش زا است و ممکن است خود به خود در تماس با هوا آتش بگیرد. بویی که از سوختن آن تولید میشود شبیه بوی سیر است. فسفر سفید خیلی کم در آب حل میشود برای همین میتوان آن در زیر آب به صورت جامد نگهداری کرد. البته فسفر سفید در بنزن، روغن، کربن دیسولفید و دیسولفور دیکلرید نیز حل میشود.
فرآوری و کاربرد
راههای گوناگونی برای تولید فسفر سفید وجود دارد. یک فرایند آن است که فسفات کلسیم که از سنگهای فسفاتی بدست میآید را در حضور کربن و سیلیس[۱] در کورههای برقی یا فسیلی حرارت دهیم با این کار عنصر فسفر به صورت بخار آزاد میگردد و میتوان آن را به صورت فسفریک اسید جمع آوری کرد.
چگالی فسفر در حالت گازی نشان دادهاست که این ماده در دمای کمتر از ۸۰۰ درجهٔ سانتی گراد به صورت چهار اتمی (P۴) است و در دماهای بالاتر به صورت دو اتمی (P۲) در میآید.
این ماده در دمای نزدیک به ۵۰ درجهٔ سانتی گراد اگر در هوای آزاد باشد، خود به خود آتش میگیرد البته برشهای نازک آن در دماهای پایین تر نیز میتوانند آتش بگیرند. این سوختگی به صورت زیر است:
- P۴ + ۵ O۲ → P۴O۱۰
به دلیل همین ویژگی فسفر سفید است که از آن در اسلحه سازی استفاده میشود.
مکعب ناموجود P۸
فسفر سفید میتواند به فسفر قرمز که از نظر ترمودینامیکی پایدارتر است تبدیل میشود. شکل مکعبی فسفر، P۸ در محیطهای فشرده دیده نشدهاست ولی مشتقاتی از این مولکول فرضی از فسفالکینها بدست آمدهاست.[۲]
فسفر قرمز
فسفر قرمز از حرارت دادن فسفر سفید تا دمای ۲۵۰ °C یا ۴۸۲ °F یا با قرار دادن آن در برابر نور خورشید بدست میآید. این ماده به عنوان یک آمورف شبکهای در دسترس است. اگر فسفر قرمز آمورفی را بیشتر حرارت دهیم بلوری میشود. این دگرشکلی از فسفر در هوای آزاد و در دماهای پایین تر از ۲۴۰ °C آتش نمیگیرد در حالی که فسفر سفید در دمای ۳۰ درجه نیز میتواند شعله ور شود. اگر فسفر قرمز را تا دمای ۲۶۰ °C حرارت دهیم میتواند به فسفر سفید دگرگون شود. هنگامی که کبریت کشیده میشود نیز پدیدهای شبیه این رخ میدهد.
دسترسی به این ماده در روسیه و باقیماندهٔ کشورهای اتحاد جماهیر شوروی به دلیل کاربرد آن در تولید غیر قانونی آمفتامین، کنترل شده و محدود است.
فسفر بنفش هیتورف
فسفر تکشیب (فسفر مونوکلینیک) یا فسفر بنفش همچنین با نام دیگر فسفر فلزی هیتورف.[۳][۴] هیتورف در سال ۱۸۶۵ فسفر قرمز را در یک ظرف دو سر بسته تا دمای ۵۳۰ °C حرارت داد. قسمت بالایی آن در دمای ۴۴۴ °C نگه داشته شد
فسفر سیاه
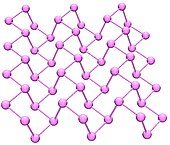
از نگاه ترمودینامیکی، فسفر سیاه شکل پایدار فسفر در دما و فشار اتاق است. این دگرشکلی از حرارت دادن فسفر سفید در فشار بالا (۱۲٬۰۰۰ اتمسفر) بدست میآید. این ماده در ظاهر، ویژگیها و ساختار بسیار به گرافیت شبیهاست. رنگ سیاه، پوسته پوسته بودن، رسانایی الکتریکی و صفحههای اتمها که در هم تنیده شدهاند، همگی از این ویژگیهایند.
سامانهٔ بلوری فسفر سیاه، راستلوزی است. این ماده در میان دگرشکلیهای فسفر از کمترین واکنش پذیری برخوردار است و این به دلیل پیوندهای داخلی شش تایی میان اتمهای آن است. هر اتم با سه اتم دیگر در همسایگی اش پیوند خوردهاست.[۵][۶] آخرین گزارشها نشان دادهاست که شیمیدانان توانستهاند ترکیبهای مصنوعی از فسفر سیاه با کمک نمک فلزات به عنوان کاتالیزور تولید کنند.[۷]
یکی دیگر از ساختارهای بلوری فسفر سیاه/قرمز جامد بلوری مکعبی است.
| | نسخه قابل چاپ | تعداد بازديد : 1563 |




 |
| 