ترکیبات یونی متشکل از تعداد زیادی آنیون ، کاتیون که با طرح معین هندسی در کنار هم قرار گرفتهاند یک بلور بوجود میآورند. هر بلور ، به سبب جاذبههای منفی ـ مثبت یونها به هم نگهداشته شده است. فرمول شیمیایی یک ترکیب یونی نشانه سادهترین نسبت یونهای مختلف برای به وجود آوردن بلوری است که از نظر الکتریکی خنثی باشد.



پیوند یونی IonicBond
پیوند یونی جاذبهای است که بین یونهای مثبت و منفی وجود دارد و آنها را در یک ساختار بلورین به هم نگه میدارد. این پیوند ناشی از انتقال الکترون بین اتم هاست.

ماهیت یون
وقتی اتمها به یون تبدیل میشوند خواص آنها شدیدا تغییرمیکند مثلا مجموعهای از مولکولهای برم قرمز است. اما یونهای در رنگ بلورماده مرکب هیچ دخالتی ندارند. یک قطعه سدیم شامل اتمهای سدیم نرم است خواص فلزی دارد و بر آب به شدت اثر میکند اما یونهای در آب پایدارند. مجموعه بزرگی از مولکولهای کلر ، گازی سمّی به زرد مایل به سبز است ولی یونهای کلرید مواد مرکب رنگ ایجاد نمیکنند و سمّی نیستند. به همین لحاظ است که یونهای سدیم و کلر را به صورت نمک طعام میتوان بدون ترس از واکنش شدید روی گوجه فرنگی ریخت. وقتی اتمها به صورت یون در میآیند ماهیت آنها آشکارا تغییر میکند.
 |
خواص مواد مرکب یونی
-
رسانایی الکتریکی :
رسانایی الکتریکی مواد مرکب یونی مذاب به این علت است که وقتی قطبهایی با بار مخالف در این مواد مذاب قرار گیرد و میدان الکتریکی برقرارشود یونها آزادانه به حرکت در میآیند این حرکت یونها بار یا جریان را از یک جا به جای دیگر منتقل میکنند. در جسم جامد که یونها بیحرکتاند و نمیتوانند آزادانه حرکت کنند جسم خاصیت رسانای الکتریکی ندارد. -
سختی :
سختی مواد مرکب یونی به علت پیوند محکم میان یونهای با بار مخالف است. برای پیوندهای قوی انرژی بسیاری لازم است تا یونها از هم جدا شوند و امکان حرکت آزاد حالت مذاب را پیداکنند. انرژی زیاد به معنی نقطه جوش بالا است که خود از ویژگیهای مواد مرکب یونی است. -
شکنندگی :
مواد مرکب یونی شکنندهاند. زیرا که ساختار جامد آنها آرایه منظمی از یونهاست. مثلا ساختار سدیم کلرید (NaCl) را در نظر بگیرید. هرگاه یک سطح از یونها فقط به فاصله یک یون در هر جهت جابجا شود یونهایی که بار مشابه دارند درکنار یکدیگر قرار میگیرند و یکدیگر را دفع میکنند و چون جاذبهای در کار نیست بلور میشکند. سدیم کلرید را نمیتوان با چکش کاری به ورقههای نازک تبدیل کرد با چنین عملی بلور نمک خرد و از هم پاشیده میشود.
|
|
![]()
گروههای حاوی پیوند یونی
عناصرگروه IA (یا فلزات قلیایی) یعنی Li ، Na ، K ، Rb ، Cs هر یک به ترتیب یک الکترون بیشتر از گازهای نجیب He ، Kr ، Ne ، Ar ، Xe دارند. اگر هر یک از این فلزات ازهر اتم یک الکترون از دست بدهند، جزء باقیمانده آرایش الکترونی گاز نجیب متناظر خود را پیدا میکند. مثلا ،Li یک الکترون والانس در آرایش حالت پایه دارد. از دست دادن یک الکترون موجب میشود که
Li ساختار الکترونی He را پیداکند. یک اتم Li که فقط دو الکترون و سه پروتون داشته باشد بار +1 خواهد داشت. یک اتم باردار مانند یا یک گروه از اتمهای باردار ، مانند گروه سولفات را یون میگویند.
-
عناصر گروه در جدول تناوبی (فلزات قلیایی خاکی) هریک دو الکترون والانس دارند. پس برای اینکه mg ، ca ، sr ، ba ساختار گاز نجیب را به دست آورند اتمهای هرعنصر باید دو الکترون از دست بدهند. از دست رفتن دو الکترون موجب میشود که دو پروتون در هسته خنثی نشده بماند. پس هر یون بار +2 خواهد داشت. برای جدا شدن سومین الکترون لازم است جفت الکترونهای تراز اصلی با انرژی پایینتر شکسته شود. این امر انرژی زیادتری میخواهد. جداشدن الکترونها از فلزات و تشکیل یونهای مثبت حاصل از آنها را میتوان به راههای مختلف ترسیم کرد.
-

باریم
پس جدا شدن یک الکترون از یک اتم معین جداشدن الکترونهای بعدی به ترتیب مشکلتر میشود. زیرا با از دست رفتن هر الکترون بار مؤثر زیادتری میشود و الکترونهای باقیمانده را محکمتر نگاه میدارد. بطور خلاصه یونهای مثبت وقتی تشکیل میشوند که اتمهای فلزی یک الکترون (گروهIA ) دو الکترون (گروهIIA) ویا سه الکترون (گروهIIIA) به اتمهای غیر فلزی میدهند. یونهای حاصل آرایش الکترونی یکسان با یک گاز نجیب دارند.
-
هالوژنها:

یونهای مثبت در حضور یونهای منفی پایدار میشوند. خنثی شدن بار ، هر دو نوع یون را پایدار میکند. یونهای منفی پایدار ، از اتمهایی که شش یا هفت الکترون والانس دارند ، تولید میشوند.اینگونه اتمها آنقدر الکترون بدست میآورند تا ساختار گاز نجیب را پیدا کنند. مثلا اتمهای عناصر گروه
VIIA (هالوژنها) هفت الکترون والانس دارند و هر یک یک الکترون میخواهند آرایش الکترونی یک گاز نجیب را پیدا کنند. اگر اتمهای
F ، Cl ، Br ، I هر یک ، یک الکترون بدست آورند، یونهای حاصل به ترتیب آرایش الکترونی گاز های نجیب را خواهند داشت.
ید
-
گروه اکسیژن:
اتم عناصر (VIA) برای رسیدن به ساختار الکترونی یک گاز نجیب هریک دو الکترون نیاز دارند. اضافه شدن دو الکترون به هم اتم سبب تولید میشود. روند به دست آوردن الکترون توسط غیرفلزات ، مانند از دست دادن الکترون توسط فلزات را میتوان به راههای متفاوت ترسیم کرد. بطور خلاصه غیرفلزات یک ، دو ، یا سه الکترون از فلزات میگیرند و یون منفی ایجاد میکنند این یونهای منفی همگی الکترونهای والانس جفت شده و آرایش هشت الکترونی پایدار گازهای نجیب را دارند.
فرمول شیمیایی مواد مرکب یونی
فرمول شیمیایی یک ماده مرکب از لحاظ الکتریکی خنثی است. خنثی بودن الکتریکی مستلزم آن است که شمار بارهای مثبت و منفی در بلور ماده مرکب برابر باشند. دو برای هر ، سه یون برای دو یون Al^3+و الی آخر. در بلور نمک طعام یونهای با جاذبه الکتریکی میان بارهای مخالف درجای خود نگاه داشته شدهاند.
علاوه بر این برای خنثی بودن این ماده مرکب باید نسبت یونهای سدیم به یونهای کلرید 1 به 1 باشد. در این صورت سادهترین فرمول آن خواهد بود. در ساختار بلورین هر یون سدیم با هر شش یون کلرید اطراف آن جذب میشود. به همین طریق هر یون کلرید با هر شش یون سدیم اطراف آن جذب میشود در ساختارهای یونی هیچ مولکول تک اتمی وجود ندارد، یعنی هیچ یون خاصی وجود ندارد که منحصرا به یک یون دیگر بپیوندد.
خواص ترکیبات یونی
می دانید که طبقه بندی پیوندهای شیمیایی در شیمی به صورت دو دسته اصلی پیوندهای یونی وکوالانسی است و انواع دیگر پیوند مانند پیوند کوالانسی قطبی و هیدروژنی و یا پیوند فلزی در رده های دیگر پیوند های شیمیایی قرار می گیرد.
در این مطلب می خواهیم به خواصی که پیوندهای یونی از خود نشان می دهند، اشاره کنیم.
دمای ذوب: ترکیبات یونی، دمای ذوب نسبتا بالایی دارند. حتی یک نمک معمولی خانگی (NaCl)، دمای ذوبی در حدود 700 درجه سانتی گراد دارد.
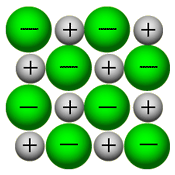
بلور (کریستال) یک ترکیب یونی توسط نیروهای بسیار قوی الکتروستاتیکی، استحکام خود را حفظ می کند، در این حالت، یون های مثبت و منفی همدیگر را جذب می کنند.
یون ها به راحتی در حالت جامد بلور ارتعاش می کنند و زمانی که به بلور یونی، گرما می دهیم تا ذوب شود، این یون ها به راحتی جریان پیدا می کنند.همان گونه که در شکل سمت راست نیز دیده می شود، یون ها در بلور یونی به صورت بسیار نزدیک و پکیده در کنار هم توسط نیروهای الکتروستاتیکی قرار گرفته اند و برای مثال در بلور NaCl، هر یون با 6 یون با بار مخالف خود احاطه شده است.
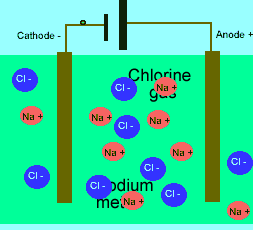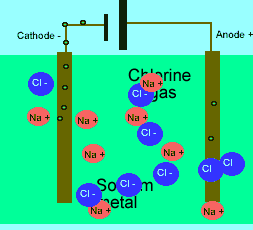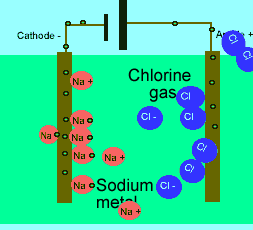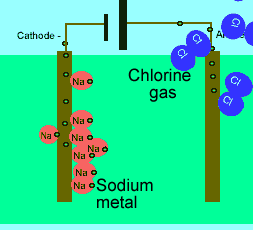
در حالت ذوب شده، یون هایی که آزادانه حرکت می کنند، می توانند یک جریان الکتریکی را از طریق خود، هدایت کنند. در حالی که در حالت جامد همین بلور یونی، مکان ثابت و آرایش بسیار کیپ یون ها اجازه هدایت جریان الکتریسیته را نمی دهد.
برای این که ببینید ترکیبات ذوب شده یونی چگونه الکتریسیته را هدایت می کنند، شکل زیر را در مورد الکترولیز نمک طعام ذوب شده ببینید.
باید بدانید که نیروهای الکتروستاتیکی در شبکه بلوری، در جهت های بسیار ویژه عمل می کنند و همین باعث می شود، ترکیبات یونی بسیار شکننده باشند.
زمانی که یک نیرو به یون های بلور یونی (که یون های آن با بارهای مخالف در کنار هم قرار گرفته اند) اعمال می کنیم (مثلا چکش بر آن فرود می آید)، این یون ها از خط و آرایش قبلی خود خارج شده و نزدیک یون هایی با بار مشابه خودشان قرار می گیرند؛
بنابراین
اکنون نیروی دافعه است که باعث از هم پاشیده شدن شبکه یونی با اعمال یک نیرو (مثل چکش) می شود.
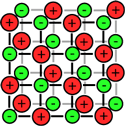
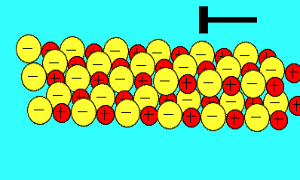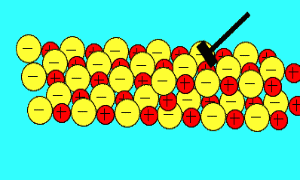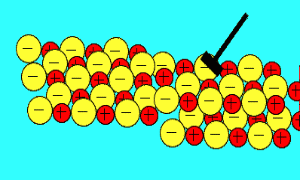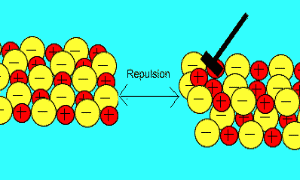
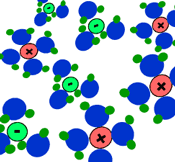
بیش تر ترکیبات یونی، قابل انحلال در آب هستند. در محلول آبی، به دلیل خاصیت از هم جدا کنندگی مولکول های آب، بارهای ترکیب یونی از هم جدا می شوند.
مولکول های آب با مختصر باری که در اتم های اکسیژن(مختصر بار منفی) و هیدروژن(مختصر بار مثبت) دارند، از بین این یون ها حرکت می کنند و جاذبه الکتروستاتیکی بین آن ها را از بین می برند.
مولکول های آب، یون ها را احاطه می کنند و به راحتی از هر نقطه محلول عبور می کنند. اگر ترکیبات یونی در محلول می توانند جریان الکتریکی را هدایت کنند، به دلیل آن است که یون های آزاد (که به راحتی حرکت می کنند)، باعث این کار شده اند.
برای این که حل شدن ترکیبات یونی را ببینید، شکل بالا را تماشا کنید. به این نکته دقت کنید که مولکول های آب چگونه خودشان را به اطراف یون های مختلف در محلول می رسانند.
| | نسخه قابل چاپ | تعداد بازديد : 210 |







 |
| 