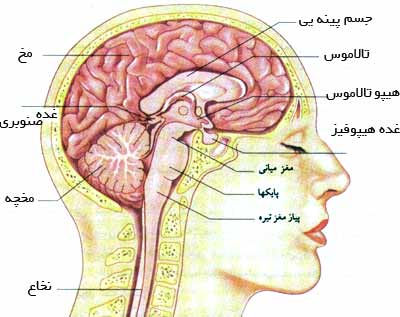
مجاري نيمدايره اي سه مجراي كوچك هستند كه هر كدام دو سوم يك دايره هستند.
مجاري نيمدايره اي شامل مجاري نيمدايره اي استخواني و غشايي است.
مجاري نيمدايره اي استخواني سه مجراي كوچك هستند كه عبارتند از:
1-فوقاني (قدامي)
2-خلفي (تحتاني)
3-خارجي (افقي)

يك انتهاي هر يك از مجاري نيمدايره اي متسع (گشاد) شده و آمپولا را ايجاد مي كند. مجاري نيم دايره اي غشايي در داخل مجاري نيم دايره استخواني واقع شده اند و مشابه آنها هستند. با اين تفاوت كه بسيار كوچك ترند. يك انتهاي هر يك از اين مجاري متسع بوده و انتهاي آمپولي ناميده مي شود.
در محلي كه آمپولاي مجاري غشايي به قسمت مشابه در لابيرنت استخواني متصل است، قسمتي از ديواره آمپولا ضخيم مي شود و ستیغ آمپولاري نام دارد. درون اين ستيغ رشته هاي عصبي مربوط به قسمت تعادلي عصب شنوايي تعادلي قرار دارد. عقيده بر اين است كه مجاري نيم دايره اي در تعادل بدن در حركات چرخشي و زاويه اي نقش دارند. مجاري نيم دايره مي توانند حتي قبل از آن كه واقعاً عدم تعادل به وجود بيايد پيش بيني كنند كه عدم تعادل مي خواهد ايجاد شود. به اين ترتيب، لازم نيست كه شخص به هيچ وجه از حال تعادل خارج شود تا مجاري شروع به تصحيح اين وضعيت كند.
مخچه نيز همانند مجاري نيمدايره اي در حركات تعادلي بدن نقش پيش بيني كننده را دارد و جالب اين جا است كه انهدام بخش هايي از مخچه (به نام لوب (بخش) هاي فولكوندولر) از عمل طبيعي مجاري نيمدايره اي نيز جلوگيري مي كند.
اوتريكول و ساكول هنگامي كه سر در وضع نزديك به قائم قرار دارد، به طور فوق العاده مؤثري به حفظ تعادل عمل مي كنند. در واقع شخص مي تواند حتي نيم درجه عدم تعادل هنگام خم شدن بدن از وضعيت قائم را تشخيص دهد. به عبارت ديگر اوتريكول و ساكول در حفظ تعادل سكوني نقش دارند.
همچنين اين دو كيسه به تشخيص شتاب خطي كمك مي كنند. به عنوان مثال وقتي بدن به طور ناگهاني به جلو پرتاب مي شود، يعني هنگامي كه بدن شتاب بر مي دارد، اطلاعات مربوط به عدم تعادل، از طرف اين دو كيسه به دستگاه عصبي مركزي ارسال مي شود و موجب مي شود كه شخص احساس كند كه گويي دارد به طرف عقب سقوط مي كند. اوتريكول و ساكول با پيام هايي كه به دستگاه عصبي مي فرستند قسمتي از اطلاعات لازم براي جهت يابي شخص در فضا را تأمين مي كنند.
اين دو كيسه برخلاف مجاري نيمدايره اي و مخچه نقش پيش بيني كننده ندارند و تا زماني كه شخص از حالت تعادل خارج نشده باشد، قادر به تشخيص اين عدم تعادل نيستند.
| | نسخه قابل چاپ | تعداد بازديد : 159 |
دستگاه عصبی (Nervous system) از دو نوع سلول تشکیل شده است:
*سلول عصبی بنام نورون (Neuron) که واحد عملی دستگاه عصبی است
سلول عصبي
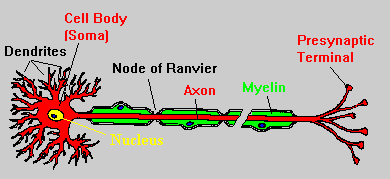
سلول عصبي، واحد دستگاه عصبي ميباشد. به هر سلول عصبي يك نورون ميگويند. هر نورون از سه قسمت تشكيل شده كه شامل: جسم سلولي و دو زايده به نامهاي دندريت و آكسون ميباشد.
اجزای یک نورون
هر نورون از دو قسمت تشکیل می گردد:
*جسم سلولی (پریکاریون یا سوما) یا تنه سلولی که شامل هسته و سیتوپلاسم است
*زوائد یا استطاله ها بنام دندریت و آکسون. هر نورون می تواند چندین دندریت داشته باشد ولی یک آکسون دارد.
اندازه پریکاریونها متفاوت است (بین 4 الی 135 میکرون) اشکال آن کروی ، ستارهای ، هرمی و گاه گلابی است. احتمالا در قشر مخ تنها 14 میلیارد نورون وجود دارد. نورونها معمولا دارای هستههای درشتاند که درون آنها یک یا چند هستک وجود دارند.
نورونها گاه محتوی رنگدانههایی میباشند مانند ملانین در هسته سیاه واقع در مغز میانی و یا رنگدانههای محتوی آهن در هسته گلوبوس پالیدوس و همچنین در هسته قرمز. جایگاه پریکاریون نورونها و یا فقط پریکاریون آنها اغلب به صورت متراکم داخل گرههای عصبی یا گنگلیونها قرار دارند. این گرهها هم در سیستم عصبی محیطی به نام گانگلیونهای حسی نخاعی- مغزی و با گنگلیونهای حرکتی احشایی و هم درون سیستم عصبی مرکزی به نام هسته وجود دارند.
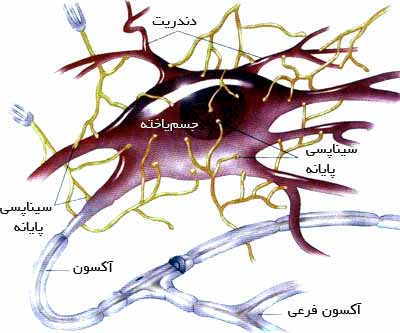
دندریت (Dendrite): دندریت یا دندریت ها، سیگنال عصبی را به طرف جسم سلولی هدایت می کند .این زوائد اصولا کوتاه هستند ولی گاهی بلند بوده که در این موارد ازلحاظ ساختمانی شبیه آکسون می باشند.
هر نورون، ميتواند داراي يك يا چند دندريت باشد، اما فقط ميتواند يك آكسون داشته باشد.
پايانه اکسون (axon terminal): به قسمت انتهایی اکسون گفته می شود که دارای ویزیکول هایی است که در آن ها نوروترانسمیترهای مختلف وجود دارد. نوروترانسمیترها موادی هستند که در موقعی که پتانسیل عمل به سلول عصبی می رسد آزاد می شوند که در ادامه بیشتر به آن ها می پردازیم.
ادامه مطلب...
| | نسخه قابل چاپ | تعداد بازديد : 800 |

دو حس بویایی و چشایی را میتوان از قدرتمندترین عوامل موثر در بهبود عملکرد سیستم گوارشی بدن به حساب آورد. در حقیقت حس چشایی عبارت است از احساس طعم و مزه مواد شیمیایی محلول که برای مثال در قالب مواد غذایی که میخوریم وارد دهان میشود. قسمت اصلی حس چشایی روی سطح فوقانی زبان قرار گرفته است و بزاق دهان به عنوان مادهای که موجب انحلال مواد شیمیایی مختلف موجود در انواع غذاها میشود، نقش مهمی در احساس طعم و مزه غذاها ایفا میکند.
حس بویایی نیز عبارت است از احساس این مواد شیمیایی از طریق گیرندههای حسی که قادر به دریافت عطر و رایحه این مواد هستند. حس بویایی در مقایسه با حس چشایی طیف عملکردی گستردهتری دارد و حتی میتواند عطر و رایحه مواد و ترکیباتی که در محیط اطرافمان پراکنده است را نیز بهخوبی احساس کند. بسیاری از محققان و دانشمندان بر این باورند که شدت حساسیت حس بویایی در مقایسه با دیگر حواسی که از آنها در مجموعهای به عنوان حواس پنجگانه بدن نام برده میشود 1000 برابر بیشتر است. گیرندههای حسی بویایی در اعماق حفره بینی و در سطح سلولهای پوششی بویایی مستقر شدهاند. براساس محاسبات انجام شده در سطح سلولهای پوششی بینی حدود 25 میلیون گیرنده بویایی وجود دارد. عمر مفید سلولهای بویایی حدود 30 روز است و پس از آن، سلولهای جدیدی جایگزین سلولهای قبلی خواهند شد.
سلول های گیرنده حس بویایی، سلول های بویایی هستند. این سلول ها در اصل سلول های عصبی دوقطبی هستند که خاستگاه اصلی آن ها در دستگاه عصبی مرکزی است. این سلول ها به وفور دیده می شوند و در لابه لای سلول های پشتیبان وجود دارد. انتهای مخاطی سلول بویایی دارای یک برجستگی است که از این برجستگی مژه های بویایی به داخل موکوسی که سطح داخلی حفره ی بینی را می پوشاند برجسته شده اند.
این مژه های بویای کف پوش متراکمی را در مخاط تشکیل می دهند و این مژه ها هستند که با بو های موجود در هوا واکنش داده و سلول های بویایی را تحریک می کنند.

حس بویایی
قسمتی از هر سلول بویایی که به محرک های شیمیایی بوییدنی پاسخ می دهد مژه های بویایی هستند. ماده ی بودار پس از برخودار با سطح غشای بویایی ابتدا به داخل موکوس پوشاننده ی مژه ها انتشار یافته سپس به پروتئن های گیرنده در غشای مژه متصل می شود.
هر پروتئین گیرنده چندین بار سطح غشا را طی می کند و به داخل و خارج چین می خورد. ماده ی بودار به قسمتی از پروتئین گیرنده که به سمت خارج چین خورده است متصل می شود. این پروتئین در سمت داخل با پروتئین – G جفت می شود و ماده ای به نام آدنیلات سیکلاز را فعال می کند.
این ماده به نوبه خود سبب فعال شدن مولکول دیگری می شود و در نهایت کانال های دریچه دار یون سدیم باز می شود و مقادیر زیادی یون سدیم به داخل سیتوپلاسم ریخته می شود. این یون ها پتانسیل الکتریکی را در جهت مثبت سوق داده و بدین سان سبب تحریک نورون های بویایی شده و پتانسیل عمل از طریق عصب بویایی وارد دستگاه سیستم عصبی می گردد.
یک سر هر یک از این گیرندههای بویایی به پیاز بویایی متصل شده و وظیفه انتقال اطلاعات ثبت شده از طریق حس بویایی را به عهده دارد و به این ترتیب پیاز بویایی میتواندمحرکهای عصبی و اطلاعات مربوط به آن را از این طریق به مغز ارسال کند. سر دیگر گیرندههای بویایی به مجموعهای از تاژکها یا تارموهای میکرسکوپی منتهی میشود که به عنوان یک پوشش حفاظتی در سطح غشای مخاطی بینی عمل میکنند. حس بویایی قادر است بیش از 10 هزار عطر و رایحه مختلف را از هم تشخیص دهد. زبان و قسمت اصلی حس چشایی است که دارای 5 تا 12 هزار پرز چشایی است. هریک از این پرزهای چشایی به طور متوسط از 50 گیرنده حسی تشکیل شده که عمر مفید آنها 10 روز است. به محض فرو بردن غذا در دهان یا کمی قبل از آن غدد بزاقی فعال شده و مایعی با خاصیت قلیایی را که همان بزاق است در داخل دهان ترشح میکند. بزاق یک حلال شیمیایی است که به کمک زبان مواد موجود در غذاها را تجزیه کرده و به حس چشایی کمک میکند تا بتواند طعم و مزه انواع مختلف غذاها را تشخیص دهد. زبان به کمک پرزهای قارچی شکلی که در سطح آن قرار دارد و موجب ناهموار شدن سطح زبان میشود به ما کمک میکند تا بتوانیم طعم انواع موادغذایی را که میخوریم احساس کنیم. بخش جلوی زبان، طعم و مزه شیرینی دو گوشه کناری زبان در قسمت جلو طعم شوری، دو قسمت کناری در قسمت عقب طعم ترشی و انتهای زبان نیز طعم تلخی را احساس میکند و به این ترتیب حس چشایی به کمک زبان انواع طعمها را در چهار گروه اصلی شیرین، شور، ترش و تلخ از هم تشخیص داده و شناسایی میکند.
| | نسخه قابل چاپ | تعداد بازديد : 84 |
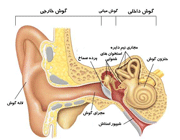
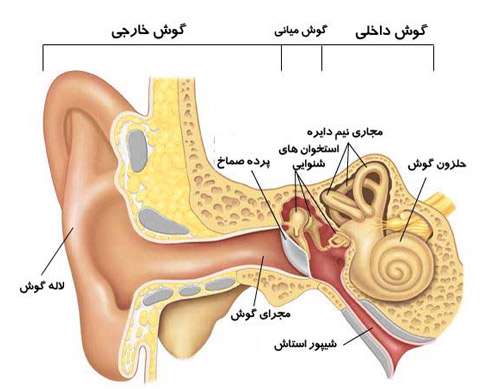
گوش انسان از سه قسمت تشکیل شده است که عبارتند از:
گوش بیرونی:شامل لاله گوش و مجرای گوش است و عمل آن ها انتقال اصوات از بیرون به داخل گوش میانی است. برای جلوگیری از نفوذ ذرات به داخل گوش یکسری مو های کوچک و یکسری غدد چسبناک در گوش وجود دارد.
گوش میانی:
گوش میانی فضایی است که در آن هوا وجود دارد و درون آن كوچك ترین استخوان های بدن قرار دارد. این استخوانچه ها،چكشی، سندانی و ركابی نام دارند که به خاطر شکل ظاهریشان به این نام خوانده می شوند و از یك طرف به پرده گوش (پرده صماخ) و از طرف دیگر به لایه نازك دیواره گوش داخلی چسبیده اند.
دسته ی استخوانچه چکش به پرده ی صماخ چسبیده است و استخوانچه ی چکشی توسط رباط های ظریفی به استخوانچه سندانی متصل است به طوری که با حرکت استخوانچه چکشی، استخوانچه ی سندانی نیز حرکت می کند. سر دیگر استخوانچه ی سندانی با تنه ی استخوانچه ی رکابی مفصل می شود و تنه ی استخوانچه رکابی در مقابل لابیرنت غشایی حلزون قرار می گیرد. هم چنین گوش میانی از طریق شیپور استاش به حلق مرتبط است. (برای درک بهتر، این قسمت را با توجه به شکل زیر مطالعه کنید).
شیپور استاش كمك می كند تا فشار هوا در گوش میانی با فشار هوای محیط یکسان باشد احساس فشار یا كیپی در گوش هنگام سرماخوردگی یا هنگام سفر با هواپیما به علت بسته شدن شیپور استاش است.
در گوش داخلی صدا های ورودی، توسط حلزون گوش دریافت می شود. حلزون پر شده است از مایعی كه در این مایع، مژك های سلول های مویی شناور هستند. امواج صوتی باعث حركت این مایع و در نتیجه حركت سلول های مویی می شود. این سلول ها در نهایت به عصب شنوایی متصلند كه اطلاعات شنیداری را به قسمت شنوایی مغز منتقل می كند.
اگر صوت با شدت زیاد به گوش ما بخورد امکان پارگی پرده صماخ وجود دارد اما مکانیسمی در گوش وجود دارد که صوت های وارد شده را اگر از یک حد بالاتر باشند تضعیف می کند. به این ترتیب که وقتی امواج صوتی از طریق استخوانچه ها و از آنجا به داخل سیستم عصبی مرکزی می رسند رفلکسی ایجاد می شود که سبب انتقباض عضله رکابی می شود.
به این ترتیب دسته ی چکشی به سمت داخل کشیده شده و استخوانچه رکابی به سمت خارج می رود. این دو نیرو مخالف هم عمل کرده و باعث سفتی تمام استخوانچه ها می شوند و به این ترتیب هدایت استخوانچه ای اصوات به شدت کم می شود.
عمل اصلی انتقال صوت به مراکز بالاتر مغزی توسط گوش داخلی انجام می شود. به طوری که درون بخش حلزونی، 3 مجرا قرار دارد که از یکدیگر جدا می باشند. بر روی دو مجرای فوق اندامک های به نام کرتی قرار دارد که مجموعه سلولی حساس الکترومکانیکی به نام سلول های مویی می باشند.
این اندامک ها، اندامک های انتهایی گیرنده می باشند که در پاسخ به ارتعاشات صوتی، پیان های صوتی را تولید می کنند.خود این سلول های کرتی از دو نوع سلول تشکیل شده اند که خم شدن مژک ها به یک طرف سبب دپولاریزاسیون سلول های مژکدار و خم شدن آن ها به سمت مقابل سبب هیپرپلاریزاسیون سلول ها می گردد.
درون این مجرا ها نیز مایعاتی وجود دارد که یکی دارای پتاسیم بیشتر و دیگری دارای سدیم بیشتر است. همین اختلاف یون ها سبب ایجاد یک پتانسیل 80+ میلی ولت می گردد به طوری که داخل مجرای مثبت و بیرون آن منفی می گردد. قطر فیبر ها موجود در بخش حلزونی از قاعده حلزون به سمت رأس آن افزایش می یابد.بنابراین اصوات با فرکانس بالا در قاعده و اصوات با فرکانس کم در قسمت رأس شناسایی می شوند.
| | نسخه قابل چاپ | تعداد بازديد : 65 |
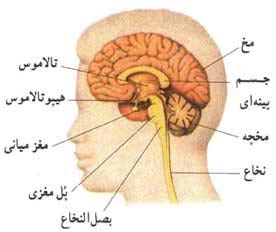
مخ آدمی بیش از مخ هر جانور دیگری پیشرفت کرده است. لایهٔ بیرونی آن، قشر مخ نام دارد (در زبان لاتینی cortex یعنی 'پوست درخت' ). قشر مخ (که غالباً فقط قشر - cortex خوانده میشود) مغزی که در آزمایشگاه نگهداریشده خاکستری رنگ بهنظر میرسد زیرا قشر مخ بیشتر، از جسم یاختهەای عصبی و رشتههای بدون میلین تشکیل شده است، و اصطلاح 'مادهٔ خاکستری' هم بههمین معنی اشاره دارد. بخش زیرین قشر مخ، یا درون آن، عمدتاً از آکسونهای میلیندار تشکیل یافته و سفیدرنگ بهنظر میرسد. ساختار قشر مخهریک از دستگاههای حسی (بینائی، شنوائی، بساوائی و ...) اطلاعات را به مناطق خاصی از قشر مخ منعکس میکنند. حرکات اندامهای بدن (پاسخهای حرکتی) در مهار مناطق دیگری از قشر مخ قرار دارند.
 هر نیمکره چند قطعهٔ بزرگ دارد که شیارهائی آنها را از هم جدا میکنند. علاوه بر این قطعات که از بیرون دیده میشوند، تاخوردگی داخلی بزرگی از قشر مخ بهنام اینسولا (insula) نیز در عمق شیار جانبی قرار دارد. الف- نمای جانبی مغز، ب- نمای مغز از بالا، ج-برش طولی قشر مخ. بهتمایز بین بخش سطحیتر مادهٔ خاکستری (بخش پررنگتر) و مادهٔ سفید بخش عمقی توجه کنید.
هر نیمکره چند قطعهٔ بزرگ دارد که شیارهائی آنها را از هم جدا میکنند. علاوه بر این قطعات که از بیرون دیده میشوند، تاخوردگی داخلی بزرگی از قشر مخ بهنام اینسولا (insula) نیز در عمق شیار جانبی قرار دارد. الف- نمای جانبی مغز، ب- نمای مغز از بالا، ج-برش طولی قشر مخ. بهتمایز بین بخش سطحیتر مادهٔ خاکستری (بخش پررنگتر) و مادهٔ سفید بخش عمقی توجه کنید.
ادامه مطلب...
| | نسخه قابل چاپ | تعداد بازديد : 179 |

1. انقباض ماهيچههاي مخطط ارادي در سراسر بدن، مانند انقباض ماهيچههاي مخطط پاها در هنگام راه رفتن
2. انقباض ماهيچههاي صاف غيرارادي، مانند انقباض ماهيچههاي صاف ديواره رودهها به منظور ايجاد حركت دودي
3. ترشح غدد مانند ترشح هورمون از غده فوق كليوي در اثر تحريك عصب سمپاتيك
-------------------
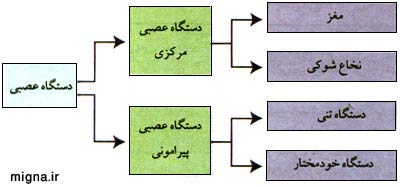
1. دستگاه عصبي مركزي كه شامل مغز و نخاع است.
2. دستگاه عصبي محيطي يا پيراموني كه شامل اعصاب مغزي، اعصاب نخاعي و دستگاه عصبي خودكار ميشود.
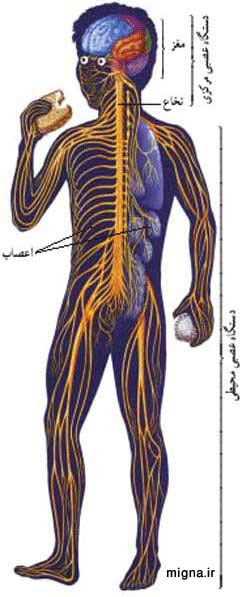
دستگاه عصبی محیطی(peripheral nervous system)PNS،
الف) اعصاب جمجمه ای- نخاعی. اعصاب جمجمه ای ۱۲ جفت، اعصاب نخاعی ۳۱ جفت.
ب) سیستم عصبی خودکار( اتونوم): شامل ۱. سیستم عصبی سمپاتیک( از مهره های پشتی- کمری)
۲. سیستم عصبی پاراسمپاتیک( جمجمه ای- خاجی) همهٔ قسمتهای دستگاه عصبی با هم ارتباط متقابل دارند، اما برای بحث میتوان آن را به دو دستگاه که هریک دارای دو بخش است تقسیم کرد. (شکل زیر)
۱. هستهٔ مرکزی.
۲. دستگاه کناری (دستگاه لیمبیک).
۳. نیمکرههای مغز (cerebral hemispheres) (که با هم، مخ cerebrum نام دارند).
در (شکل سه لایه متحدالمرکز مغز آدمی) نحوه قرار گرفتن این لایهها را نسبت به یکدیگر میبینید. این شکل را میتوان با شکل مفصلتر برش مغز آدمی در (شکل مغز آدمی) مقایسه کرد.

ادامه مطلب...
| | نسخه قابل چاپ | تعداد بازديد : 676 |
مغز مداد به طور عمده از گرافیت تشکیل شدهاست، مغرهای مدادی که در مداد به کار میروند، بسته به میزان خاک رسی که با آنها ترکیب میشود، دارای سختی متفاوتی هستند؛ مداد سخت، نمره۴، خطوط بسیار کمرنگ، و مداد نرمتر، نمره۱، خطوط پررنگی روی کاغذ ایجاد کند، هرچه میزان خاک رس ترکیبی با گرافیت مغز مداد بیشتر باشد، مداد سختتر است.
| | نسخه قابل چاپ | تعداد بازديد : 119 |
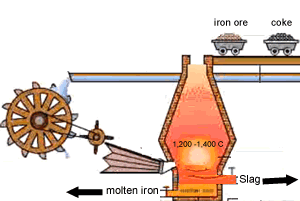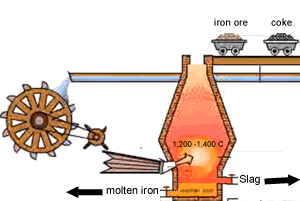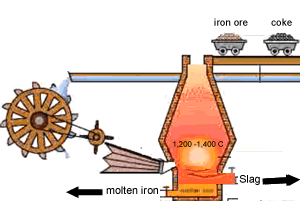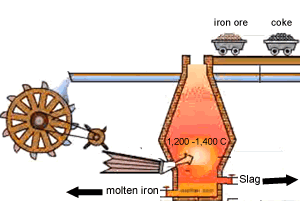
۱- مخلوط سنگ آهن ،کک (بیشتر کک را کربن تشکیل میدهد)، و سنگ آهک(کربنات کلسیم) به بالای کوره برده می شود
۲- پیستون بالای کوره پایین آمده و اجازه می دهد تا مواد اولیه به درون کوره رها شود
هوای گرم از پایین به جایی دمیده می شود که کوره ذوب آهن نام گرفته است این هوای گرم گاهی با اکسیژن تقویت می شود
۳- واکنش کک و اکسیژن در هوای گرم ،دی اکسید کربن و گرما ایجاد می کند.
۴- دی اکسید کربن تشکیل شده افزایش پیدامی کند با کک ورودی واکنش داده مونو اکسیدکربن تشکیل می دهد
۵- منو اکسید کربن ،اکسیژن را از اکسید آهن می گیرد و تشکیل آهن و دی اکسید کربن می دهد آهن ذوب شده به طرف ته کوره جاری می شود
۶- سنگ آهک به زدودن ناخالصی ها کمک می کند واکنش سنگ آهک با ناخالصی ها خاکستر یا سرباره را تشکیل می دهد سرباره عمدتا کلسیم سلیکات است که روی آهن ذوب شده شناور است و فلز را از اکسید شدن به وسیله هوای ورودی حفظ می کند آهن و سرباره با هم مخلوط نمی شوند و دو لایه جداگانه در ته کوره تشکیل می دهند
7- سرباره در فواصل معین از کوره خارج می شود از سرباره اغلب در ساخت جاده ها استفاده می شود
آهن نیز از راه دیگر خارج شده و بیشتر آهن به دست آمده از کوره در تهیه فولاد مورد استفاده قرار می گیرد.


ادامه مطلب...
| | نسخه قابل چاپ | تعداد بازديد : 9766 |
ترکیبات یونی متشکل از تعداد زیادی آنیون ، کاتیون که با طرح معین هندسی در کنار هم قرار گرفتهاند یک بلور بوجود میآورند. هر بلور ، به سبب جاذبههای منفی ـ مثبت یونها به هم نگهداشته شده است. فرمول شیمیایی یک ترکیب یونی نشانه سادهترین نسبت یونهای مختلف برای به وجود آوردن بلوری است که از نظر الکتریکی خنثی باشد.



پیوند یونی IonicBond
پیوند یونی جاذبهای است که بین یونهای مثبت و منفی وجود دارد و آنها را در یک ساختار بلورین به هم نگه میدارد. این پیوند ناشی از انتقال الکترون بین اتم هاست.

ادامه مطلب...
| | نسخه قابل چاپ | تعداد بازديد : 202 |
سیلیسیم دیاکسید (با ترکیب شیمیایی SiO۲) پایهای ترین مادهٔ سازندهٔ شیشه است. در طبیعت، در اثر برخورد آذرخش با ماسه واکنش شیشهشدگی کوارتز رخ میدهد که در نتیجهٔ آن یک ساختار توخالی (لولهای) ریشه مانند، به نام سنگ آذرخشی پدید میآید.
شیشهٔ سیلیسی که در درجهٔ نخست از سیلیس ساخته شده است به دلیل داشتن دمای انتقال بالای ۱۲۰۰ درجهٔ سانتیگراد، برای کاربردهای ویژهای مورد نیاز است اما برای عموم چندان کاربرد ندارد[۲] به همین دلیل چند مادهٔ خام دیگر هم به ترکیبات آن افزوده میشود تا فرایند ساخت را آسان تر کند. یکی از این مواد سدیم کربنات (Na۲CO۳) است که دمای انتقال شیشه را پایین میآورد. سدیم کربنات باعث میشود تا شیشه در آب قابل حل شود، برای جلوگیری از این ویژگی مقداری آهک (اکسید کلسیم CaO) که از سنگ آهک بدست میآید، به همراه اکسید منیزیم (MgO) و آلومینا (Al۲O۳) به آن افزوده میشود تا شیشه پایداری بیشتری پیدا کند. شیشه در نهایت از ۷۰ تا ۷۴ درصد وزنی سیلیس ساخته شده است و شیشه آهک سوددار نام دارد.این گونه از شیشه ۹۰ درصد از شیشهٔ تولیدی را دربر میگیرد.
بیشتر شیشههای در دسترس مواد خام دیگری هم دارند تا ویژگیهای آنها اندکی تغییر کند برای نمونه شیشهٔ کریستال و برخی گونههای بلور، نسبت به شیشههای معمولی درخشان تر اند چون دارای ضریب شکست، پاشش نوری و بازتاب بالاتری اند. افزودن باریم باعث افزایش ضریب شکست میشود. دیاکسید توریم به شیشه ضریب شکست بالا و پاشش نوری پایین میدهد درگذشته از این گونه شیشه در ساخت عدسیهای با کیفیت بالا بهره برده میشد اما به دلیل واپاشی هستهای کاربرد آن متوقف شد و با اکسید لانتان جایگزین شد.[نیازمند منبع] افزودن آهن به شیشه باعث میشود تا شیشه بتواند انرژی فروسرخ را جذب کند این ویژگی در فیلترهایی که باید گرما را جذب کنند مانند نورافکنهای فیلم برداری مورد نیاز است. همچنین اکسید سریم (IV) باعث میشود تا شیشه طول موجهای فرابنفش را جذب کند

ادامه مطلب...
| | نسخه قابل چاپ | تعداد بازديد : 82 |
دارمشتادیوم(Darmstadtium) از عنصرهای شیمیایی جدول تناوبی است. نشانه کوتاه آن Ds و عدد اتمی آن ۱۱۰ است.این عنصر برای اولین بار در ۸ دسامبر ۱۹۹۴ در «Gesleschaft fr Schwrionenforschung» در دارمشتات آلمان ساخته شد. با انجام عمل بمباران اتمی نیکل ۶۴ و بیسموت ۲۰۹ (نیکل به سمت هدف بمباران شد)، در یک شتاب دهنده خطی، تنها سه اتم از آن ساخته شده است(همه آنها Uuu-۲۷۲ بودند).
رونتگنیوم (Roentgenium یا به نام آیوپاک "Unununium") یکی از عنصرهای شیمیایی جدول تناوبی است.
رونتگنیوم نام سابق آن یونونیونیوم (Unununium)که علامت آن Uuu نیز هست یکی از عناصر شیمیایی جدول تناوبی است که نماد آن Rg و عدد اتمی آن ۱۱۱ میباشد. با وزن اتمی ۲۸۰ یکی از اتمهای فوق سنگین است.
نام این عنصر را به احترام ویلهلم کنراد رونتگن (Wilhelm Konrad Roentgen) فیزیکدان آلمانی و کاشف اشعه X، رونتگنیوم گذاشتند. رونتگن در سال ۱۹۰۱ موفق به دریافت اولین جایزه نوبل فیزیک گردید. یک مجادله نامگذاری عناصر بر سر نام این عنصر در جریان بود تا بالاخره در اول نوامبر سال ۲۰۰۴، آیوپاک نام جدید آنرا انتخاب کرد.
اونونبیوم یکی از عناصر شیمیایی جدول تناوبی است که نماد آن Uub و عدد اتمی آن 112 میباشد. این عنصر یکی از عناصر بسیار سنگین میباشد که اتمهایش از طریق نشر ذرات آلفا در نیمه عمر 240 µs متلاشی میشوند.
این عنصر با ترکیب اتم روی و اتم سرب از طریق شتاب دادن به Nuclei روی در یک شتاب دهنده یونی سنگین کشف شد. نام اونونبیوم با توجه به سازمان IUPAC انتخاب شد. با این وجود بحثهایی در خصوص نام گذاری مجدد این عنصر همچنان وجود دارد.
اونوتریوم(به انگلیسی: Ununtrium) (ju:ˈnʌntriəm یا /əˈnʌntriəm/) یک نام موقت برای عنصری با نمادUut و عدد اتم ۱۱۳ است.
که در واکنشهای هستهای بدست میآید. و اولین بار از واپاشی اونونپنتیوم بدست آمد. تاکنون فقط هشت اتم از این عنصر دیده شدهاست. و یک فلز شناخته میشود.
فلروویوم (به انگلیسی: Flerovium) یک عنصر شیمیایی واپاشی هستهای با نماد FL و عدد اتمی ۱۱۴ است که قبلاً با نام آنانکادیوم (به انگلیسی: ununquadium) شناخته میشد.که بسیار خطرناک است، این نام به افتخار بنیانگذار واکنشهای هستهای، گئورگی فلرو انتخاب شدهاست. محققان اولین بار فلروویوم را بعد از شلیک یونهای کلسیم به یک هدف پلوتونیومی مشاهده کردند
اونونپنتیوم(به انگلیسی: Ununpentium) (ˌju:nənˈpɛntiəm یا /ˌʌnənˈpɛntiəm/) یک نام موقت برای عنصر فوق سنگین جدول تناوبی با نمادUup و عدد اتمی ۱۱۵ است.
دو ایزتوپ آن شناخته شدهاست، Uup-287 و Uup-288.
ایزتوپ ۲۸۸ آن بخشی اعداد جادویی است به همین دلیل از پایداری خاصی برخوردار است
لیورموریوم (به انگلیسی: Livermorium) یک عنصر شیمیایی واپاشی هستهای با نماد Lv و عدد اتمی ۱۱۶ است که قبلا با نام آنانهگزیوم (به انگلیسی: Ununhexium) شناخته میشد. قرار بود به افتخار منطقهای در مسکو، مسکوویم (moscovium) نام بگیرد، اما محققان آمریکایی توانستهاند برنده جدال نام گذاری این عنصر شوند. این عنصر به افتخار شهر محققان آمریکایی لیورمور، کالیفرنیا نامگذاری شد. در سال ۲۰۰۰، وقتی که دانشمندان دو عنصر کلسیم و کوریوم را با هم ترکیب کردند، عنصر لیورموریوم مشاهده شد.
چهار ایزتوپ با عدد جرمی ۲۹۰-۲۹۳ شناخته شدهاند. که پایدارترین آن Uuh-293 با نیمه عمر ۶۳ میلیثانیهاست.
آنانسپتیوم(به انگلیسی: Ununseptium) (ˌjuːnənˈsɛptiəm یا /ˌʌnənˈsɛptiəm/)یک نام موقت برای عنصر کشف شده در سال 2010 است . در جدول تناوبی با نماد Uus و عدد اتمی ۱۱۷ است.این عنصر در سال 2014 ساخته شد و پس از یک دهم ثانیه از بین رفت.
آناناکتیوم نام آیوپاک موقتی برای عنصر فوق سنگین با عدد اتمی ۱۱۸ و نماد شیمیایی Uuo است. هم چنین با اکارادون یا عنصر ۱۱۸ شناخته میشود و در جدول تناوبی عناصر، یک عنصر بلوکpو آخرین عنصر دوره هفتم است. آناناکتیوم در حال حاضر تنها عضو مصنوعی گروه 18 میباشد. بزرگترین عدد اتمی و جرم اتمی بین عناصر کشف شده تاکنون را دارد.
پرتوزایی اتم آناناکتیوم، بعلت جرم زیادش، بسیار ناپایدار است و از ۲۰۰۵، فقط سه یا احتمالا چهار اتم از ایزوتوپهای 294Uuo شناخته شده است. با وجود مشخصات خیلی کم تجربی مربوط به خواص و ترکیبهای ممکن آن، محاسبات نظری منجر به پیش بینیهای متعدد و بعضا غیر منتظرهای شدهاند. برای مثال، اگرچه آناناکتیوم عنصر گروه ۱۸ است، ممکن است برخلاف دیگر عناصر گروه ۱۸، یک گاز نجیب نباشد.[یشتر تصور میشد تحت شرایط استاندارد یک گاز باشد اما اکنون به علت اثرات نسبیتی، یک جامد شناخته میشود
منبع: دانشنامه رشد
| | نسخه قابل چاپ | تعداد بازديد : 207 |


سبکترین عنصر شیمیایی است که در طبیعت ایزوتوپ پایدار ندارد. عدد اتمی آن ۴۳ و نشانه آن Tc است.
تکنسیوم پرتوزا است و ترکیبات آن که پرتو گاما میپراکند در پزشکی هستهای بکار میرود.
این عنصر برای اولین بار در آزمایشگاه دانشگاه کالیفرنیا و به مدیریت ارنست ارلاندو لارنس در ۱۹۳۶ میلادی و بواسطه یک سیلکوترون ۳۷ اینچی تولید شد. همچنین این عنصر نخستین عنصر مصنوعی ساخت بشر بوده است.
جایگاه عنصر شماره 43 مدتها قبل در جدول تناوبی شناخته شده بود که در سال 1937 کشف شد و در جدول قرار گرفت. این عنصر همچنین در کانی مولیبدنیت توسط Lawrence از بمباران دوترونها در سیکلوترون برکلی به دست آمد. تکنسیم اولین عنصری است که به صورت مصنوعی به دست آمد. از زمانی که به صورت مصنوعی به دست آمد تحقیق و جستجو روی این عنصر برای پیدا کردن در زمین و خاک شروع شد. در نهایت این عنصر در سال 1962 با ایزوتوپ شماره 99 در آفریقا با روش شکافت هسته ای اورانیم 238 توسط دو دانشمند به نامهای Kenna و Kuroda به دست آمد. تکنسیم در طیف های S, M, N ستاره ها پیدا شده است.
حدود 22 ایزوتوپ با رنج جرمی 90 تا 111 گزارش شده است. همه ایزوتوپهای تکنسیم رادیواکتیو هستند. یکی از این ایزوتوپها که عدد Z < 83 است ایزوتوپ ناپایدار هستند.Z عددی است که جمع نوترونها و پروتونها را در یک اتم نشان می دهد . و یک ایزوتوپ ناپایدار این عنصر نامش پرومتیم است که Z = 61 . بیشتر ایزوتوپهای این عنصر مفید برای رادیواکتیوهای مصارف پزشکی هستند که نیم عمر آنها کوتاه است. انرژی اشعه گامایی که از آنها ساتع می شود قابلیت فعالیت در باندهای شیمیایی را در بیولوژیک داراست. ایزوتوپ 99Tc توسط شکافت هسته ای اورانیم در راکتورهای اتمی تولید می شود. برای این عنصر از کمیت کیلوگرم استفاده می شود.
حالتهای اکسیداسیونی تکنسیم 4+ و 5+ و 7+ هستند. از نظر شیمیایی تکنسیم شبیه رنیوم است . تکنسیم قابلیت انحلال در اسید نیتریک ، تیزاب سلطانی و اسید سولفوریک غلیظ را دارد اما در اسید کلریدریک حل نمی شود. این عنصر مقاومت در برابر خوردگی برای فولاد را دارد. این عنصر خاصیت رسانایی شدید در درجه حرارت 11 کلوین را دارد.
از سال 1960 تکنسیم در دسترس قرار گرفت و قیمت آن 2800 دلار در یک گرم است.

اثرات تکنسیم بر روی سلامتی
در گزارشها آمده فولاد نرم کربنی با افزودن ppm55 KTcO4 در آب مقطر گازدار و در دمای بیش از 250 درجه سلسیوس، فولاد مقاوم می شود. این مقاومت در برابر خوردگی محدود به سیستمهای بسته است زیرا تکنسیم رادیواکتیو است و باید محصور شود. وزن مخصوص تکنسیم 98، Bq/g 108×6.2 است. با این میزان فعالیت تکنسیم نمی تواند پخش شود. تکنسیم 99 آلاینده ای خطرناک است و باید در جعبه نگهداری شود.
خواص فیزیکی و شیمیایی عنصر تکنسیم :
عدد اتمی: 43
جرم اتمی:97
نقطه ذوب : C° 2157
نقطه جوش : C° 4265
شعاع اتمی : Å 1.95
ظرفیت: 7
رنگ: خاکستری نقره ای متالیک
حالت استاندارد: جامد
نام گروه: 7
انرژی یونیزاسیون : Kj/mol 702
شکل الکترونی: Kr]5s24d5]
شعاع یونی : Å 0.56
الکترونگاتیوی: 1.9
حالت اکسیداسیون: 7و6و4
دوره تناوبی:5
ادامه مطلب...
| | نسخه قابل چاپ | تعداد بازديد : 1136 |

فلز مادهای است که میتوان آن را صیقل داده و براق کرد( بجز جيوه كه در دمای اتاق بشكل مايع است) یا به طرحهای گوناگون در آورد و از آن مفتولهای سیمی ظریف تهیه کرد. فلز جسمی است که آزمایشهای مربوط به گرما و مهمتر از همه جریان الکتریکی را به خوبی هدایت میکند. فلزات با یکدیگر فرق زیادی دارند، از جمله در رنگ و سختی و نرمی، تعدادی از آنها ممکن است به آسانی خم شده و یا خیلی محکم و مقاوم باشند.
مقاومت مکانیکی فلز
مقصود آن مقدار باری است که فلز میتواند تحمل کرده، نشکند. بسیاری از فلزات، وقتی گرم هستند، اگر تحت فشار قرار گیرند، شکل خود را زیادتر از موقعی که سرد هستند، تغییر میدهند. بسیاری از فلزات در زیر فشار متغییر مانند نوسانات، آسانتر از موقعی که سنگین باری را تحمل میکنند، میشکنند.
علت درخشش فلزات
دلیل اول آن است که با طرح ریزی و براق کردن صحیح میتوان فلزات را به شکل خیلی صاف تهیه کرد. گر چه آنها نیز تصاویر را خوب منعکس میکنند، ولی ظاهر سفید و درخشان بیشتر قطعات فلزی صیقلی شده را ندارند. بطور کلی جلا و درخشندگی فلز بستگی دارد به گروه الکترونهای آن دارد.
الکترونها میتوانند هر نوع انرژی را که به روی فلزات میافتد جذب کنند؛ زیرا در حرکت آزاد هستند. بیشتر انرژی الکترونها از تابش نوری است که به آنها میافتد، خواه نور آفتاب باشد یا نور برق. اکثر فلزات همه انرژی جذب شده را پس میدهند، به همین دلیل، نه تنها درخشان بلکه سفید به نظر میآیند.
علت تغییر شکل فلزات
بسیاری از فلزات در حرارت ویژهای، آرایش یونهای خود را تغییر میدهند. با تغییر ترتیب آرایش یونهای بسیاری از خصوصیات دیگر فلز نیز دگرگون میشود و ممکن است فلز کم و بیش شکننده، قردار، بادوام و قابل انحنا شود یا اینکه انجام کار با آن آسان گردد. بسیاری از فلزات در هنگام سرد بودن، به سختی تغییر شکل میپذیرند. بیشتر فلزات جامد را به زحمت میتوان در اثر کوبیدن به صورت ورقه و مفتولهای سیم در آورده، ولی اگر فلز گرم شود، انجام هر دو آسان است.
ادامه مطلب...
| | نسخه قابل چاپ | تعداد بازديد : 123 |
ضریب انبساط حرارتی خطیαضریب انبساط حرارتی حجمی βمادهα در 10-6/K at 20 °Cβ(=3α) در 10-6/K at 20 °Cگازوئیل950اتانول750آب207جیوه182بنزوسیکلوبوتن42126سرب2987آلومینیوم2369برنج1957نقره1854استیل ضدزنگ17.351.9مس1751طلا1442نیکل1339بتون1236استیل, depends on composition11.0 ~ 13.033.0 ~ 39.0آهن11.133.3کربن10.832.4پلاتینیوم927شیشه8.525.5گالیوم(III) آرسنید5.817.4ایندینیوم4.613.8تنگستن4.513.5شیشه, شیشه بوروسیلیکات 3.33.39.9سیلیسیوم39Invar1.23.6الماس13کوارتز (fused)0.591.77چوب بلوط 54 162چوب کاج 34102
| | نسخه قابل چاپ | تعداد بازديد : 70 |

فسفر یک عنصر شیمیایی جدول تناوبی است که نماد آن P و عدد اتمی آن 15 میباشد. فسفر یکی از نافلزات چند ظرفیتی گروه نیتروژن بوده و معمولا در سخره ها و کانی های فسفاتی و همچنین در تمام سلولهای زنده یافت میشود ولی هیچگاه به صورت طبیعی تنها و بدون ترکیب با عناصر دیگر وجود ندارد. فسفر بسیار واکنش پذیر بوده و هنگام ترکیب با اکسیژن نور کمی از خود ساتع میکند. از عناصر لازم و حیاتی ارگان های زنده بوده و نامش به شکلهای گوناگون ذکر میشود. مهمترین استفاده فسفر در تولید کود میباشد. همچنین در تولید مواد منفجرهکبریتآتش بازی مواد حشره کش خمیر دندان و مواد شوینده و همچنین مانیتورهای کامپیوتر نیز کاربرد دارد.
فسفر معمولا به شکل یک ماده جامد و موم مانند سفید رنگ است که بوی نامطبوعی دارد. فسفر خالص بی رنگ و شفاف است. اگرچه این نافلز در آب قابل حل نیست ولی در دی سولفید کربن حل میشود. فسفر خالص به سرعت در هوا میسوزد و تبدیل به پنتا اکسید فسفر میشود.
فسفر به چهار پنج شکل مختلف وجود دارد . سفید (یا زرد) قرمز سیاه (یا بنفش). که متداول ترین آنها فسفر قرمز و سفید میباشند که که هر دوی آنان از گروه چهار اتمی های چهار وجهی میباشند. فسفر سفید در تماس با هوا میسوزد و در مجاورت با گرما یا نور به فسفر قرمز تبدیل میشود که دو حالت آفا و بتا دارد که با انتقال دمای -3.8 درجه سانتیگراد از هم تفکیک میشوند. در عوض فسفر قرمز پایدار تر بوده و در فشار بخار 1 اتمسفر در 17 درجه سانتیگراد تصعید می شود و از تماس و یا گرمای مالشی میسوزد. فسفر سیاه چندشکلی Allotrope هم در ساختاری مشابه گرافیت که در آن اتمها در یک صفحه شش وجهی چیده شده و هادی جریان الکتریسیته هستند وجود دارد.
اسید فسفریک غلیظ شده که 70% تا 75% P2O))5دارد. در(( کشاورزی و تولید کود بسیار مهم میباشد. در نیمه دوم قرن بیستم نیاز بیشتر به کودها تولیدات فسفری را به مقدار قابل توجهی افزایش داد.
دیگر کاربردهای فسفر عبارتند از:
ترکیبات فسفری نقش حیاتی در تمام گونه های حیات شناخته شده در زمین دارد. فسفرهای معدنی نقش کلیدی در ملوکولهای بیولوژیکی مانند DNAو RNA که قسمتی از استقامتهای ملوکولی را شکل میدهند بازی میکنند. همچنین سلولهای زنده از فسفرهای معدنی برای ذکیره و انتقال انرژی سلولی از طریق تری فسفات آدنوزین ATP استفاده میکنند. نمکهای فسفات کلیسیوم هم توسط حیوانات برای سفت شدن استخوان استفاده میشود. ضمناً فسفر یک عضو حیاتی برای پروتوپلاسمهای سلولی و بافتهای عصبی میباشد.
فسفر (که یونانی آن فسفروس به معنای"حامل روشنایی" و از نامهای باستانی سیاره زهره میباشد ) در سال 1669توسط شیمیدان آلمانی Henning Brand در حین تولید یک دارو از ادرار کشف شد. براند با تبخیر ادرار سعی در تقطیر نمک داشت که در این فرایند ماده سفید رنگی تولید شد که در تاریکی میدرخشید و با نور زیادی میسوخت. از آن روز تابندگی فسفری برای شرح اشیاءی که در شب بدون سوختن میدرخشند بکار برده شد.
کبریتهای اولیه که از فسفر سفید در ترکیباتشان اسفاده میشد به دلیل سمی بودن خطرناک بودند و استفاده از آنها موجبات قتل و خودکشی و .... را فراهم میکرد. (یک داستان نا معلوم حکایت از این دارد که زنی با اضافه کردن فسفر سفید به غذای شوهرش قصد کشتن وی را داشت که هنگام جوشانیدن غذا به دلیل به وجود آمد بخار نورانی لو رفت.)
همچنین کارگران کبریت ساز به دلیل مجاورت با بخار آن دچار مردگی استخوانهای فک میشدند. زمانی که فسفر قرمز که خاصیت آتش زایی و سمی به مراتب کمتری را دارد کشف شد جایگزین فسفر سفید در صنعت کبریت سازی گردید.
فسفر به دلیل واکنش پذیری در هوا و دیگر مواد حاوی اکسیژن به تنهایی در طبیعت یافت نمیشود ولی به صورت ترکیبی به مقدار زیادی در معادن گوناگون پخش شده اند. که بزرگترین این معادن در روسیه مراکش فلوریدا Idaho, Tennesseو Utah قرار دارد.
فسفرهای چندشکلی سفید میتوانند به شیوه های گوناگونی تهیه شوند. در یک فرایند تری کلسیم فسفات که از سخره های فسفاتی گرفته شده در مجاورت کربن و سیلیکا در کوره های سوختی یا برقی حرارت داده میشود. در این فرایند عناصر فسفری به صورت بخار آزاد شده و به صورت اسید فسفریک جمع آوری میشوند.
فسفر یک ماده بسیار سمی میباشد و حتی مقدار 50 mg آن کشنده و مرگ آور است.
فسفر سفید باید همیشه در زیر آب نگهداری شود چرا که در مجاورت هوا بسیار واکنش پذیر میباشد. هنگام کار با آن حتما باید از انبر استفاده شود چرا که تماس آن با پوست میتواند باعث سوختگی های مزمن شود. خاصیت سمی و مزمن فسفر سفید باعث میشود که کارگرانی که باید با آن کنند دچار بیماری Necrosis of the Jaw مردگی فک که اصطلاحا PhossyJaw نامیده میشود گرفتار آیند. استرهای فسفاتی برای سیستم عصبی سمی هستند اما فسفاتهای معدنی و کانی معمولا غیر سمی میباشند.
آلودگی فسفاتی نیز زمانی رخ میدهد که کودها و مواد پاک کننده در خاک ها باقی بمانند.
هنگامی که گونه سفید آن در مجاورت نور خورشید قرار بگیرد و یا در بخار خود تا دمای 250 درجه سانتیگراد حرارت داده شود به گونه قرمز که در هوا ترکیب نمیشود تبدیل میشود. فسفر قرمز فورا در هوا آتش نمیگیرد و به خطرناکی فسفر سفید نیست. با این حال باید با فسفر قرمز نیز با احتیاط کار شود چرا که در شرایطی و در تحت دماهای خاص ممکن است به فسفر سفید تبدیل شود . ضمنا در صورت گرما دیدن گازهای بسیار سمی که حاوی اکسیدهای فسفر هستند از خود ساتع میکند.
p32 ایزوتوپ رایج است که رادیو اکتیو نیز می باشد.
تنها املاء درست این عنصر Phosphorus میباشد که به شکل صفت برای ظرفیتهای کوچکتر آن استفاده میشود و درست همانند ترکبات گوگرد (sulfurour and sulfuric) میباشد و با کلمات Phosphorous و Phosphoric نامیده میشود.
فسفر از زمان های بسیار قدیم با اهمیت دانسته شده و مورد مصرف بوده است. در بیشتر اعمال فیزیولوژیکی گیاه ، فسفر اهمیت حیاتی دارد (از آن جمله : در تولید ATP و اسید نوکلئیک و آنزیم ها)، کمبود فسفر باعث توقف رشد گیاه شده و به علت انتقال فسفر از برگ های پیر به برگهای جوان، منجر به ریزش برگهای پیر میگردد. گهگاه، کمبود فسفر باعث تجمع مواد قندی در برگ و ساقه شده و در نتیجه تولید آنتوسیانین بالا رفته و برگها و ساقه ها به رنگ قرمز در می آیند.
در خاک، فسفر ممکن است به صورت معدنی و آلی یافت شود. واکنش (pH) خاک در قابل استفاده ساختن فسفر اهمیت زیادی دارد. فسفر در خاک های قلیایی، به املاح کلسیم، و در خاک های اسیدی با آهن و آلومینیم ترکیب شده غیر قابل استفاده میشود.
بنابراین مناسبترین واکنش برای قابل استفاده بودن فسفر واکنش های 6 تا 7 می باشد. فسفر به صورت های و یا جذب گیاه می شود.
از کودهای فسفره معمول که به مصرف میرسد می توان فسفات آمونیم، را نام برد.پودر استخوان گرچه دارای فسفر زیادی می باشد ولی فسفر آن زیاد قابل جذب نیست.
ادامه مطلب...
| | نسخه قابل چاپ | تعداد بازديد : 1556 |
 |
|